有机化学知识点(二)

第三章
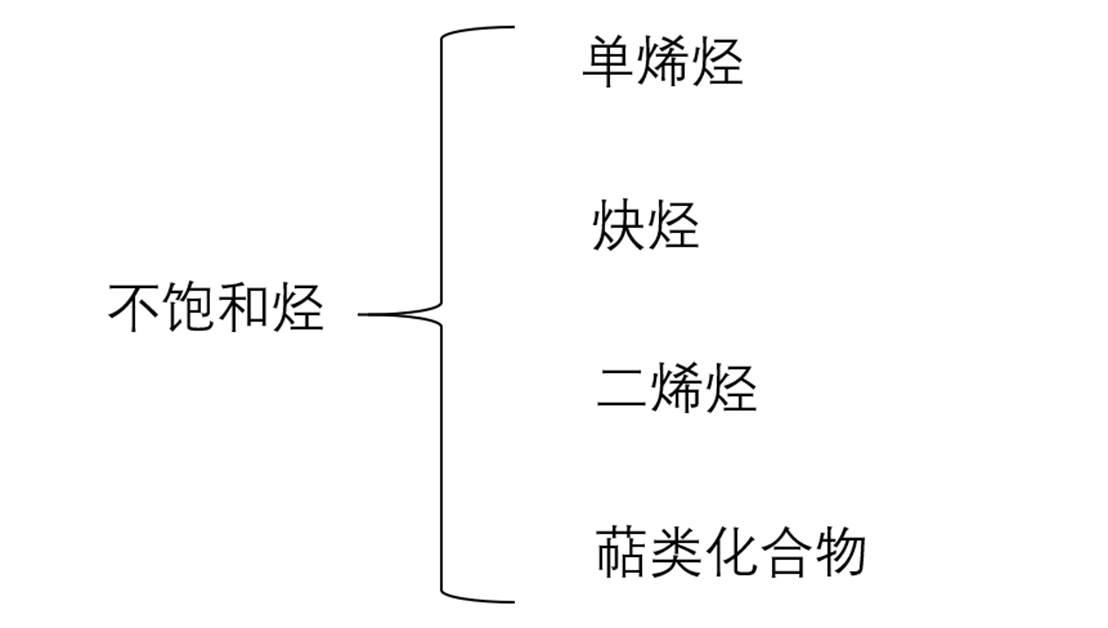
一
单烯烃
结构
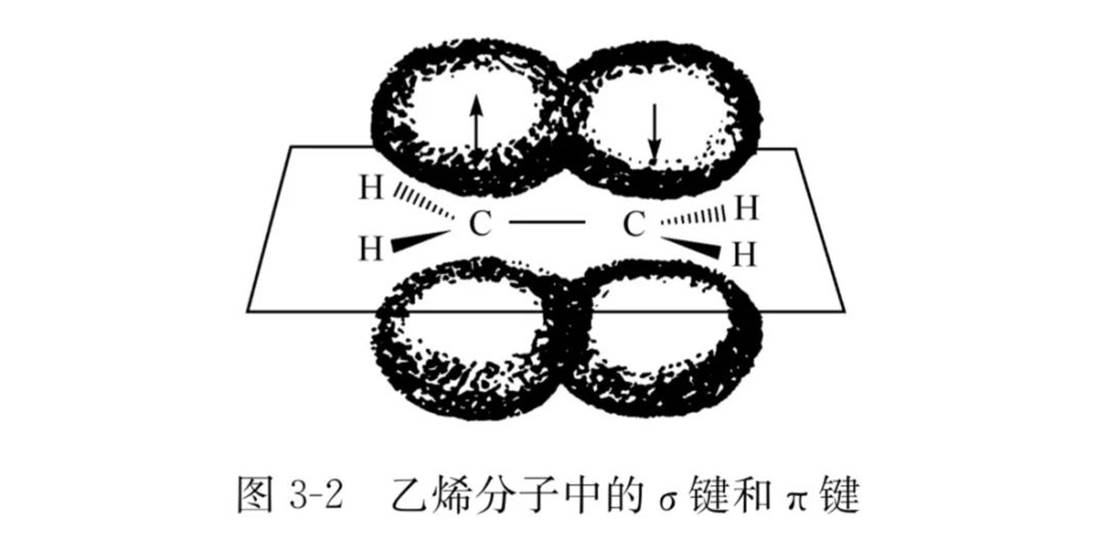
电子云形状:处于分子平面的上下两侧
分子形状:平面形
π-键特点:
1.不稳定,重叠程度小
2.π-电子流动性大(可以形成共轭效应),电子云处于分子平面上下两侧
3.不可旋转
异构和命名
异构:
构造异构:碳链异构和双键位置异构
顺反异构
命名:
(1)选主链:包含双键在内的最长碳链
(2)编号:靠近双键一端开始
(3)写名称:构型+取代基+母体(以较小位次表示双键)
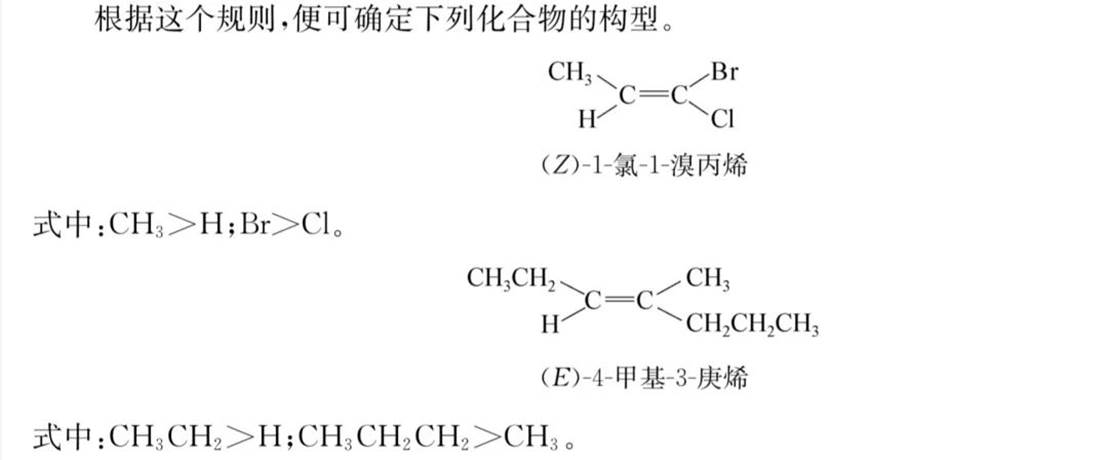
Z/E命名法:
优先基团在同侧为Z型,在异侧为E型。
物理性质
烯烃的物理性质与烷烃相似。在常温常压下,C2C4的烯烃为气体,C5C18的烯烃为液体,C19以上的为固体。它们都难溶于水,易溶于有机溶剂,密度都小于1g·mL。
化学性质——亲电加成反应(π键活泼)
与卤素加成:活性:F2>Cl2>Br2>I2
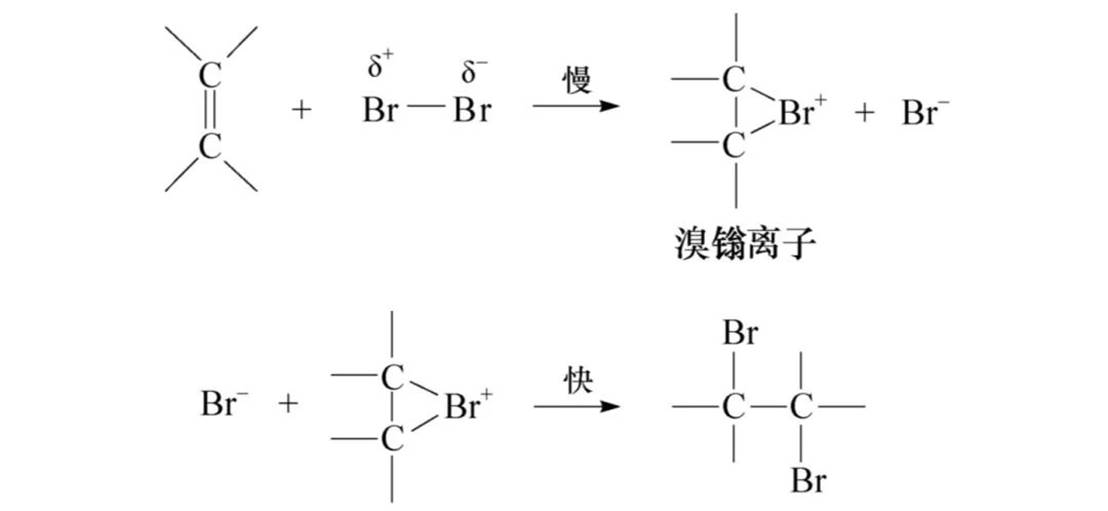
马氏规则:不对称烯烃与不对称试剂加成时,负性基团加在含氢少的碳原子上。
马氏规则的解释:(诱导效应)
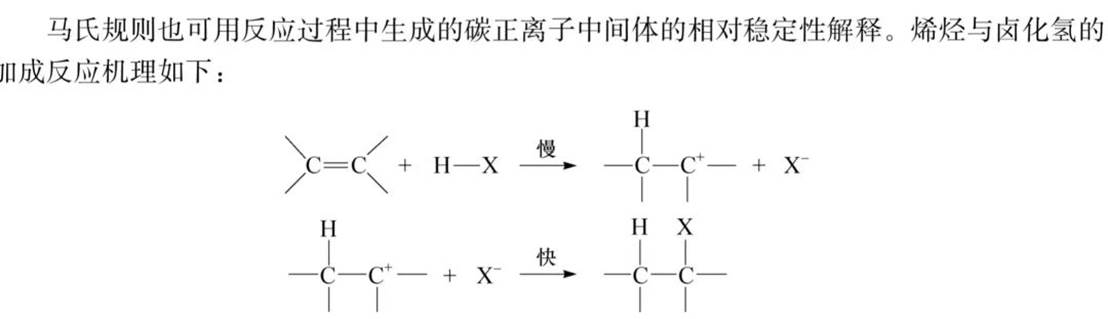
根据物理学规律,一个带电体系的电荷越分散,体系越稳定。因此,不同类型碳正离子的相对稳定性次序为

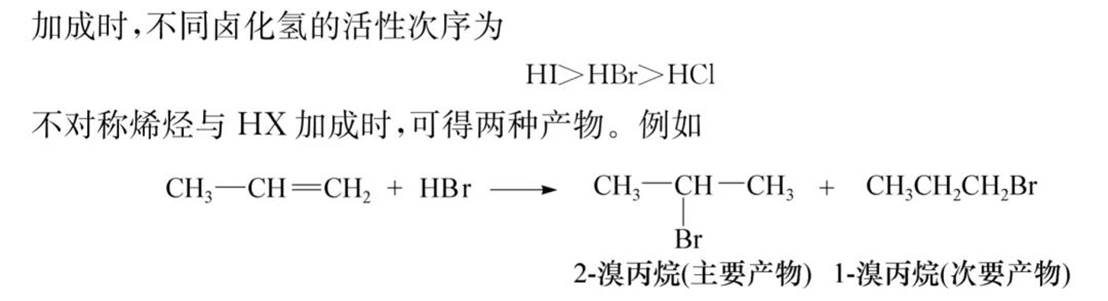
与卤化氢加成:
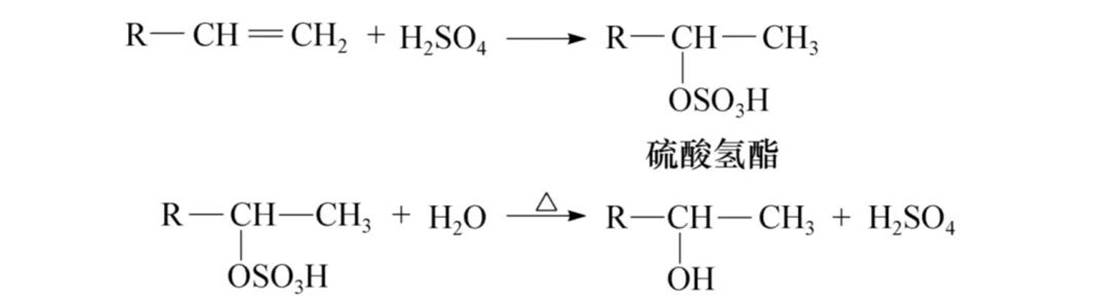
与硫酸加成:可以制取醇类和去掉烯烃
催化加氢:

化学性质——氧化反应
催化氧化:
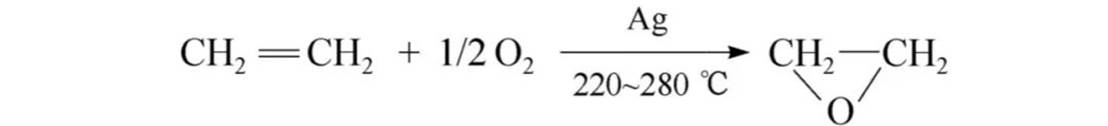
KMnO4氧化:
碱性或中性:生成顺式邻二醇
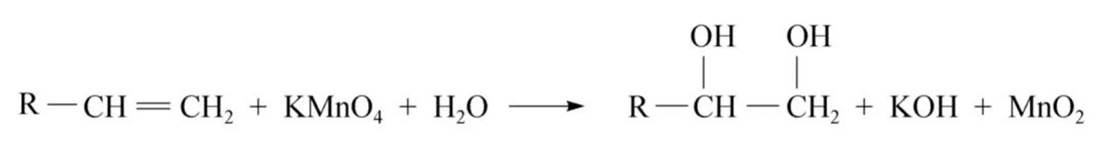
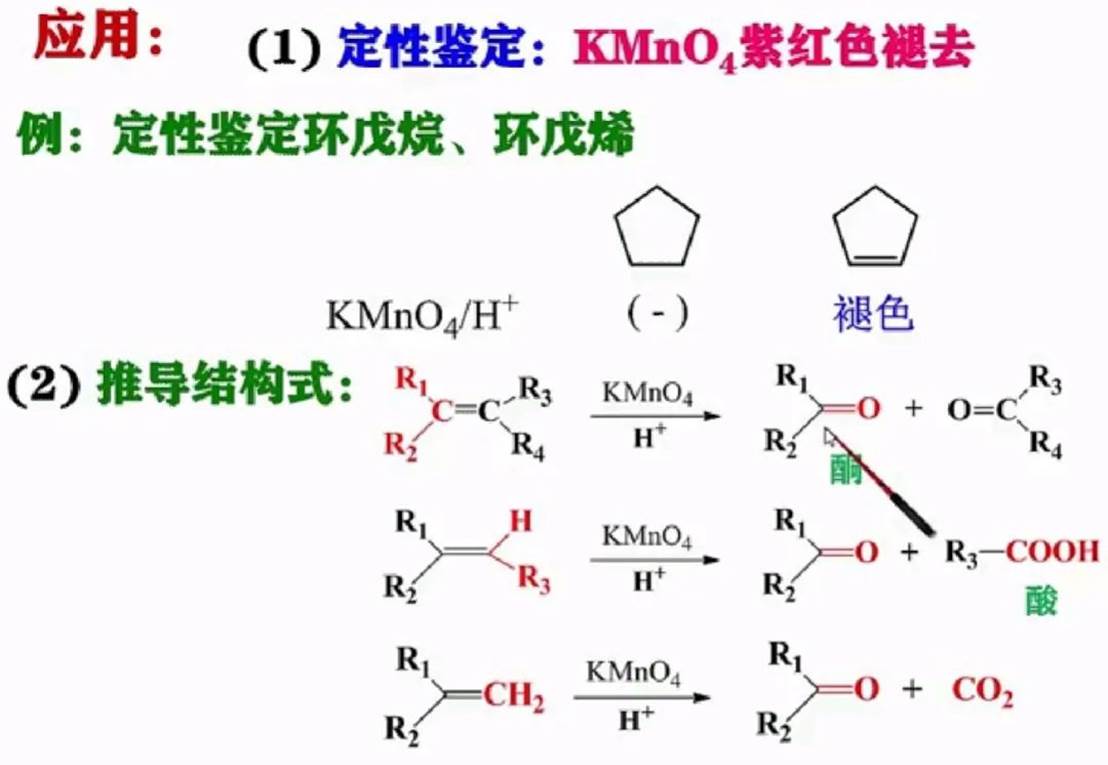
酸性:生成低级的酮、羧酸和CO2
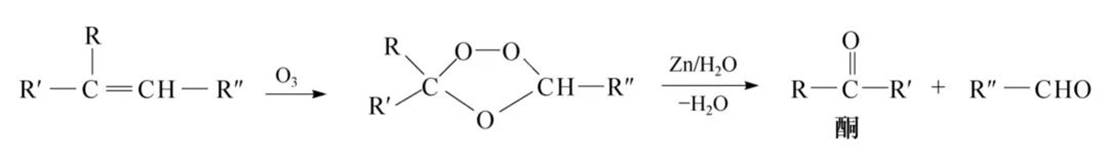
臭氧化:还原水解
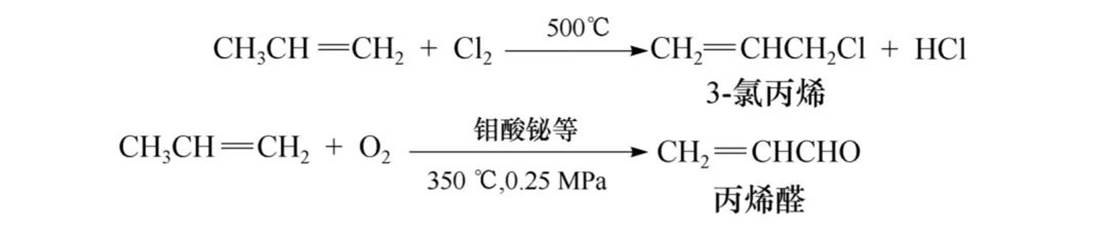
化学性质——α-H的卤代、氧化
烯烃分子中的α-氢受到双链的影响,表现出特殊的活泼性,易发生卤代、氧化等反应。
二
炔烃
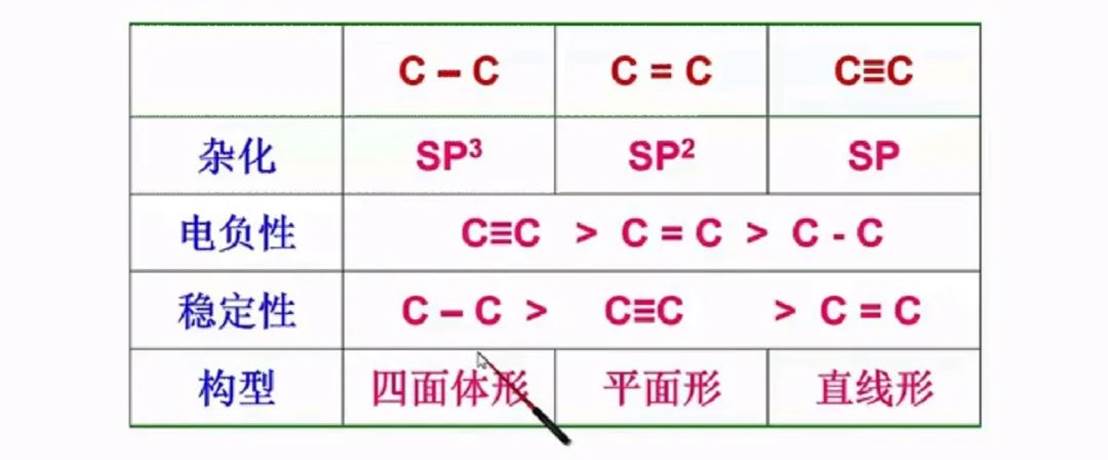
三种键的比较
异构和命名
异构:碳链异构和位置异构
命名:

化学性质
加成反应相比烯烃反应活性较小,可以通过控制反应条件来只生成烯烃
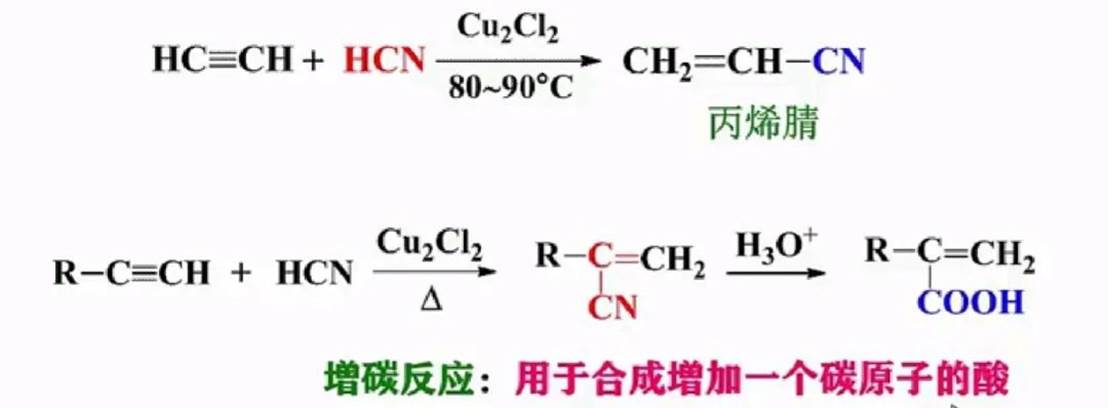
与氢氰酸加成:
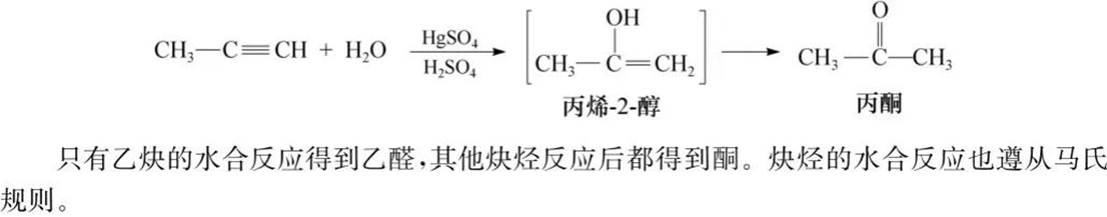
水和反应:
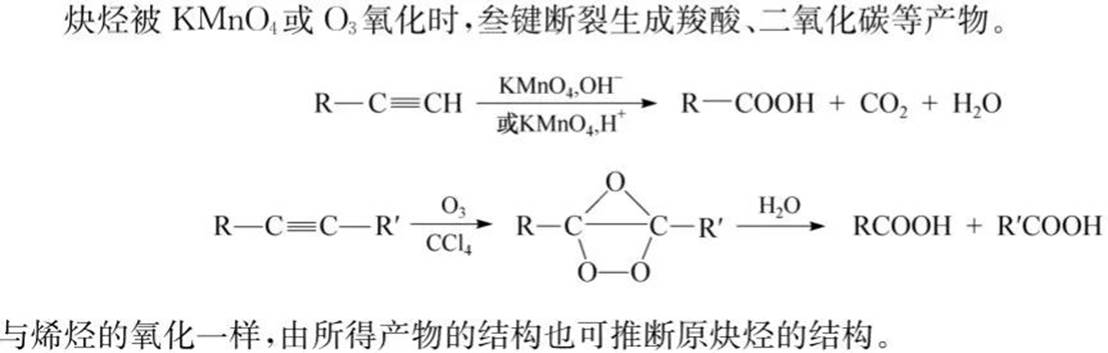
氧化反应:
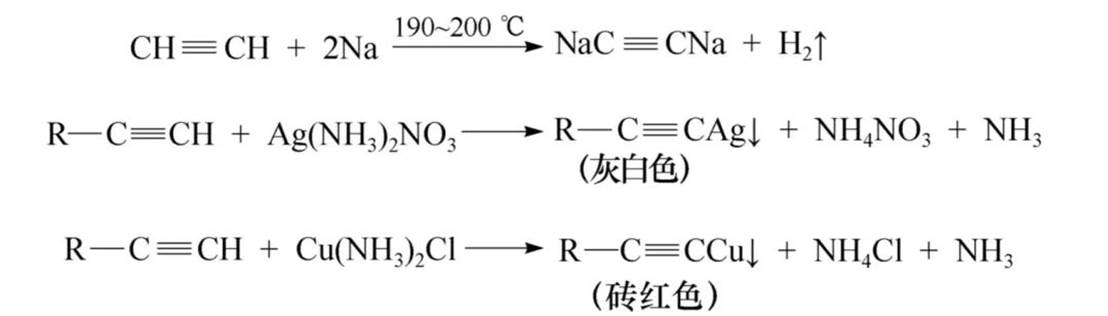
炔化物的生成:
因为叁键碳为sp杂化,sp杂化轨道中的s成分比sp2和sp3中的大,表现出较大的电负性。直接与叁键碳相连的氢原子与相应的烯烃、烷烃中的氢原子相比,更易解离质子而显弱酸性。
三
二烯烃
分类

共轭二烯烃的结构和共轭效应
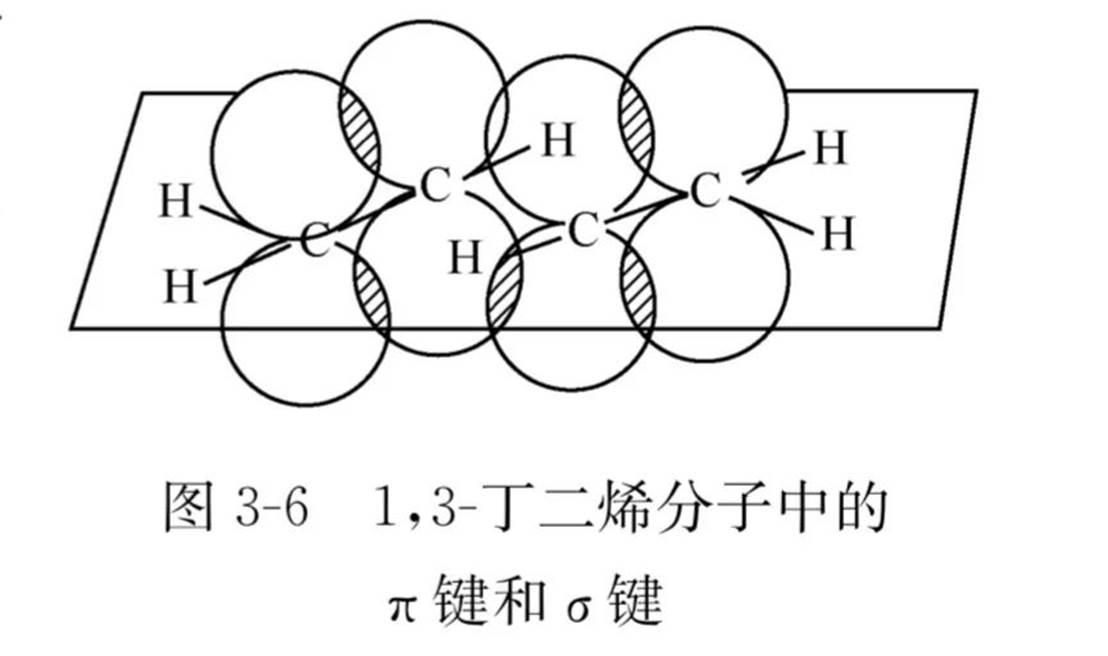
共轭体系
形成条件:
①所有原子共平面
②每个原子具有垂直于该平面的P轨道
共轭体系特点:
①所有原子共平面体系势能降低
②单双键趋于平均化
③体系势能降低,趋于稳定(降低的势能转化为离域能,共轭能)
π-π共轭
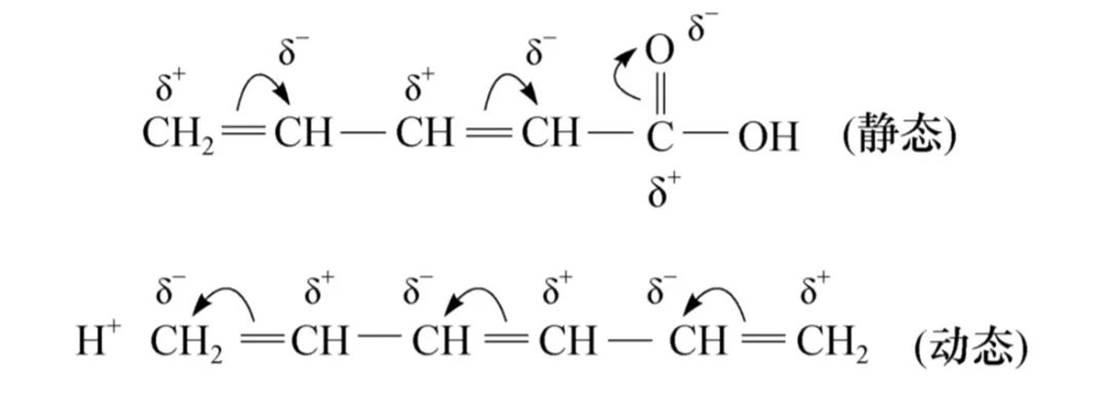
p-π共轭
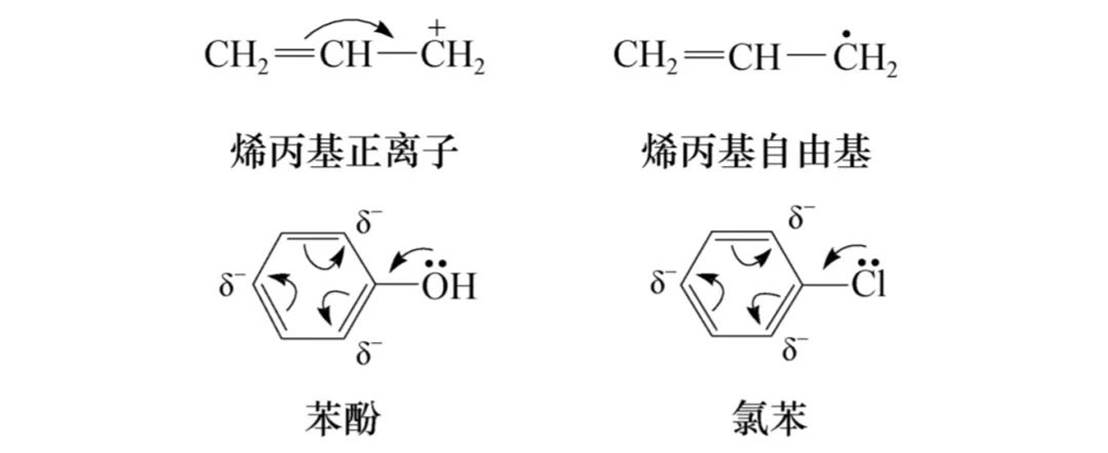
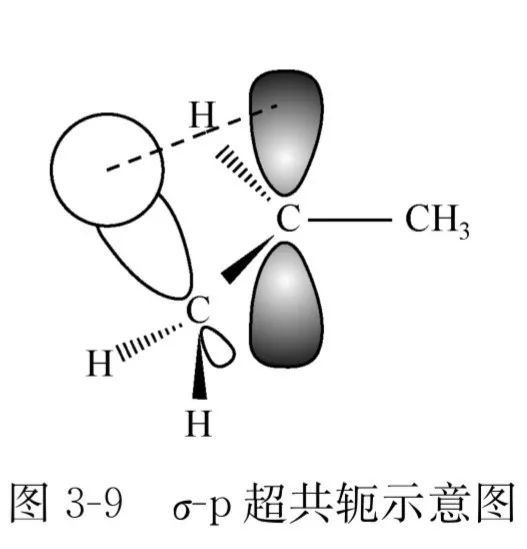
σ-π超共轭
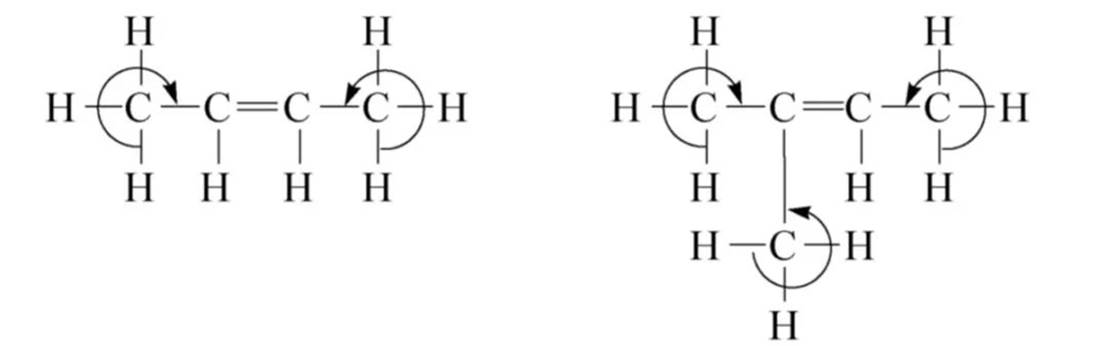
σ-p超共轭:烃基自由基和碳正离子等活性中间体
共轭效应
共轭效应:共轭体系中电子离域的效应(±C)。
+C正共轭效应:使电子云密度增大的共轭效应,供电子的共扼效应。
-C负共轭效应:使电子云密度减小的共轭效应,吸电子的共轭效应。
共轭效应特点:①在整个体系内起作用②使电子云产生疏密交替排列
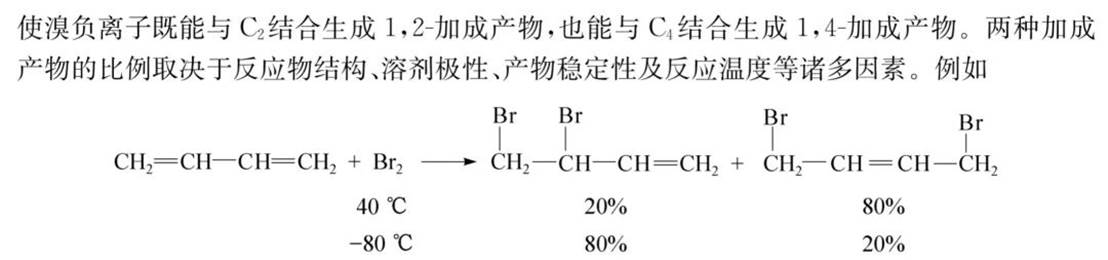
共轭二烯烃的化学性质
1-2加成和1-4加成
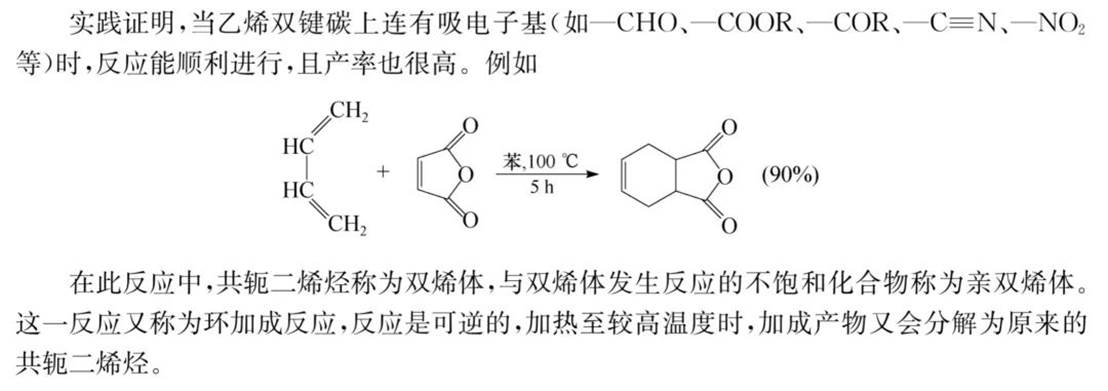
双烯合成反应
四
萜类化合物
“异戊二烯规律”
绝大多数帖类化合物的结构可以看作是由若干个异戊二烯单位首尾相连而成的链状或环状聚合物。(异戊二烯单位可以有0,1,2个双键)
分类(链萜、环萜)

举例:
倍半萜—脱落酸:

图文部分来源于网络