有机化学知识点(五)
第六章

一
卤代烃的分类和命名
分类
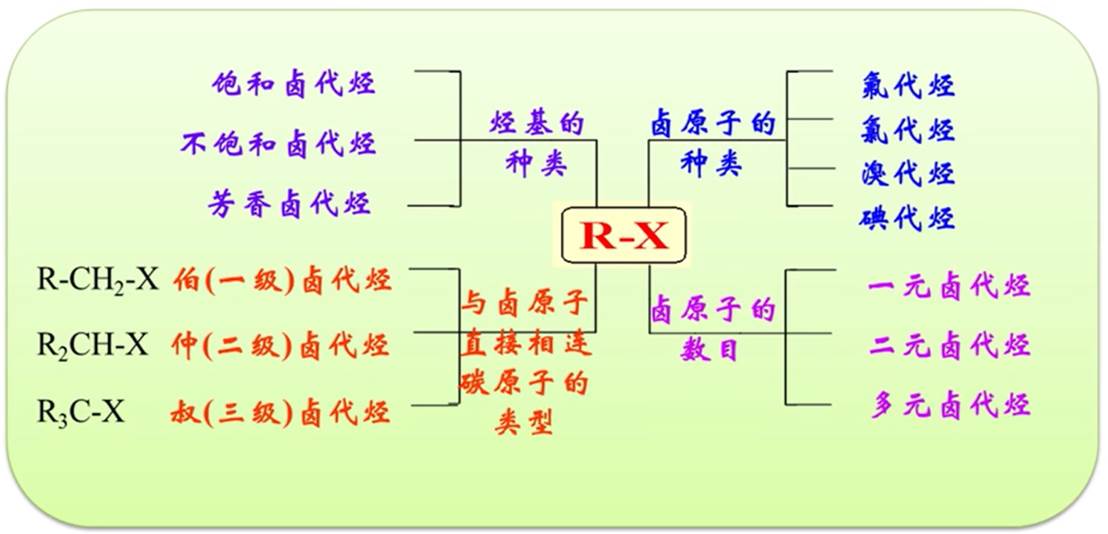
命名
(1)结构比较简单的卤代烃可用普通命名法命名,以烃为母体,卤素为取代基,称为“卤代某烃”,或按照与卤原子相连的烃基名称命名,称为“某烃基卤”。卤代芳烃则一般以卤素为取代基,芳环为母体来命名。例如
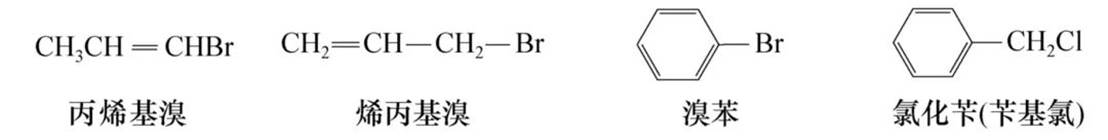
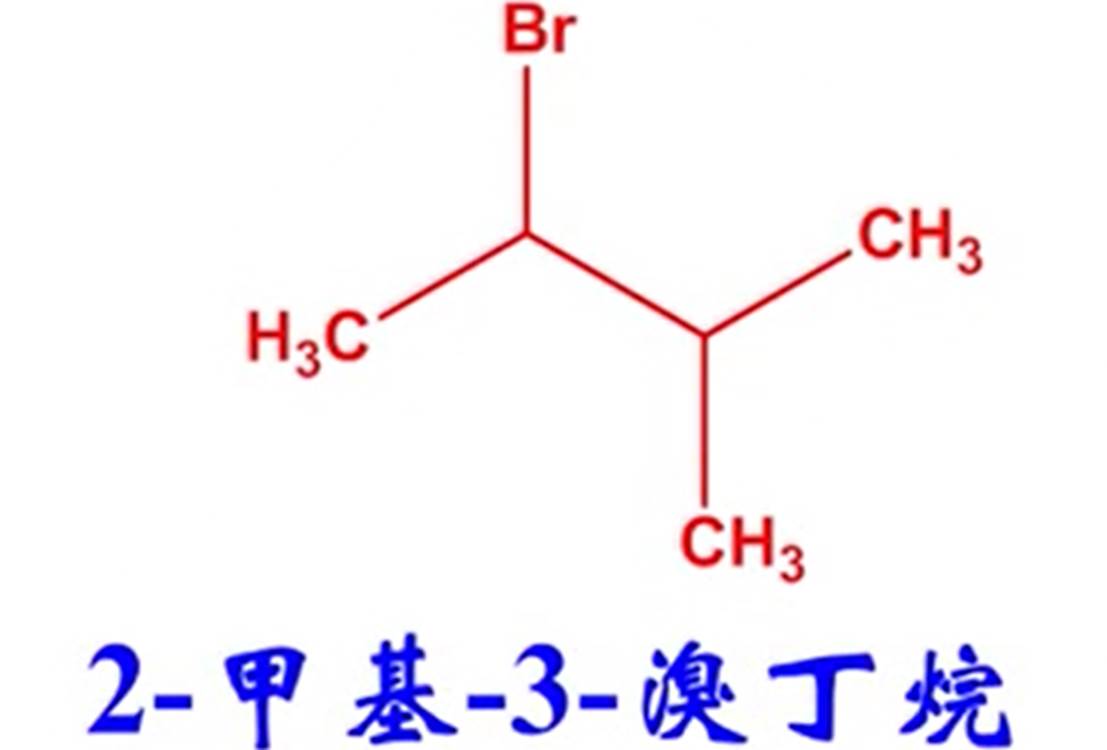
(2)系统命名法:①一般以含有卤原子所连碳在内的最长碳链为主链,卤原子和其他取代基同等看待;②碳原子编号一般从离取代基较近的一端开始,按最低序列原则进行编号;③取代基的先后顺序按次序规则,较优的原子或基团后列出。例如
(3)对于不饱和卤代烃,将含有卤素和不饱和键的最长碳链作为主链,但编号时要使不饱和键位次最小。例如

(4)卤代环烷烃与卤代芳烃通常选用脂环和芳环化合物为母体,卤原子为取代基。
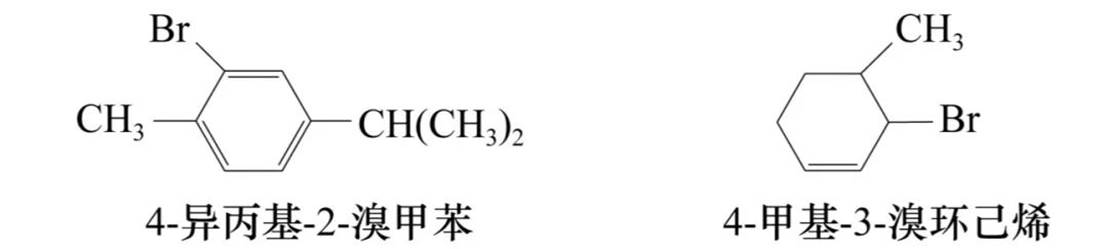
(5)书写格式:烷基取代基-卤原子-某烃。其中若为多卤代物在书写时应按F、CI、Br、I的顺序依次列出。
二
物理性质
a.难溶于水,易溶于有机溶剂;某些卤代烃本身是很好的有机溶剂。例如,CH3Cl、CH3CH2CI、Ph-Br。
b.熔沸点、相对密度均大于同碳个数的烃。
c.常温常压下,氯甲烷、氯乙烷、溴甲烷、氯乙烯和溴乙烯是气体,其余常见的一元卤代烃均为液体,十五个碳原子以上的卤代烃是固体。
三
化学性质
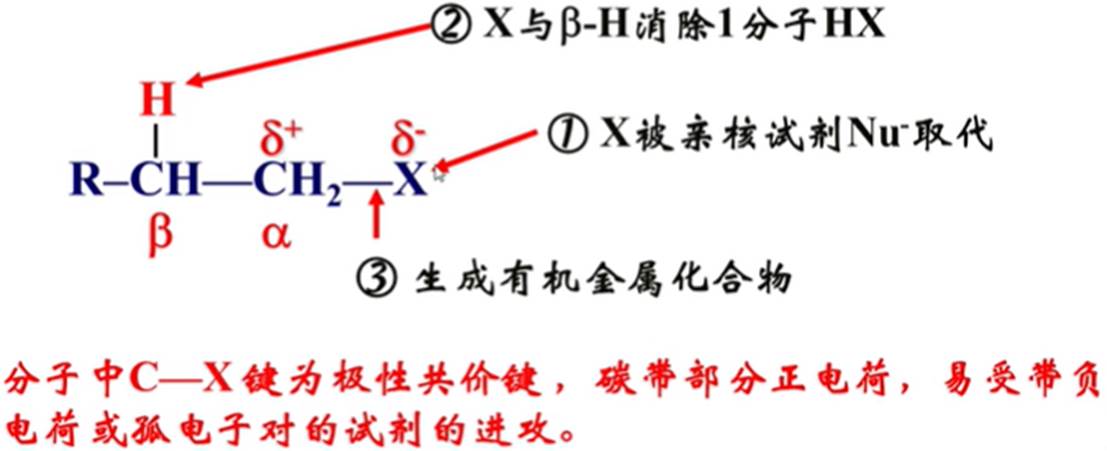
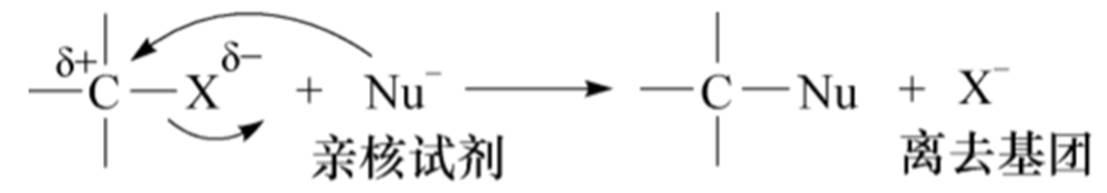
取代反应
取代:S
亲核:N
亲核试剂:Nu-
不同卤代烃反应活性:R-I>R-Br>R-CI
不同的C-X的键能:C-I<C-Br<C-CI
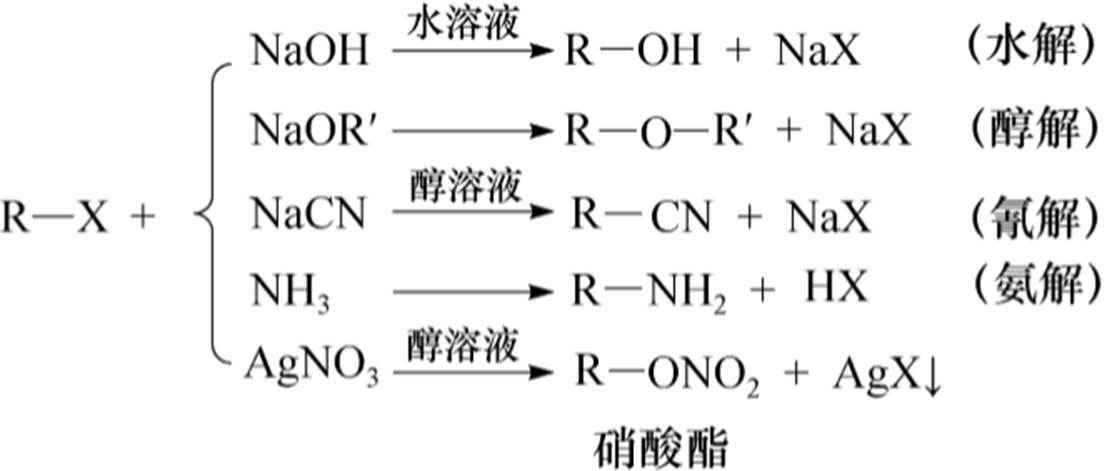
1.水解反应
2.醇解反应
采用该法以伯卤烷效果最好,仲卤烷效果较差,但不能使用叔卤烷,因为伯卤烷易发生消除反应生成烯烃。卤代醇在碱性条件下,可以生成环醚。

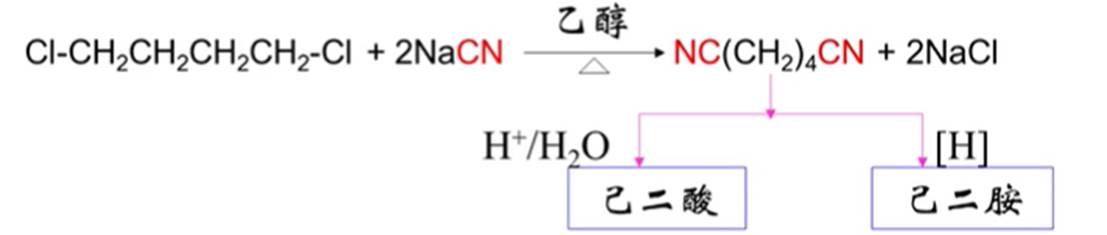
3.氰解反应
NaCN或KCN有剧毒,通过这个反应,分子中增加了一个碳原子。且腈中的CN-可转变成—COOH、—CH2NH2等官能团。
4.氨解反应
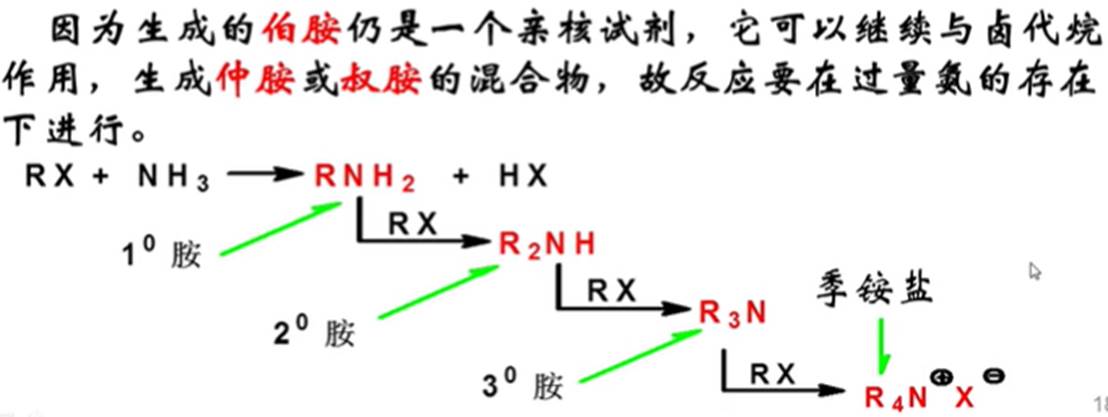
5.被硝酸根取代

拓展
伯卤(仲卤代烃和叔卤代烃易发生消除反应):

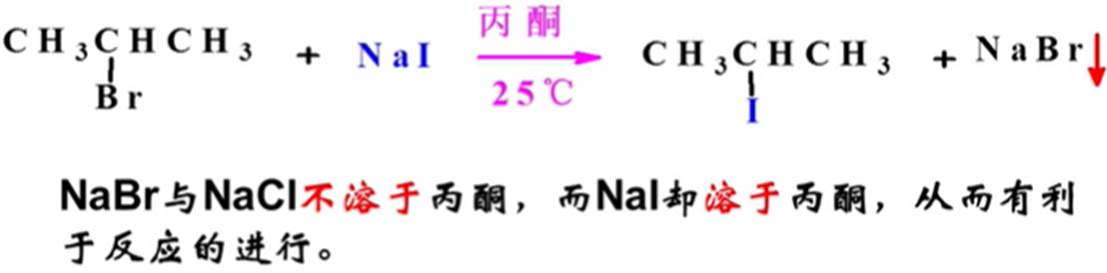
卤离子的交换:
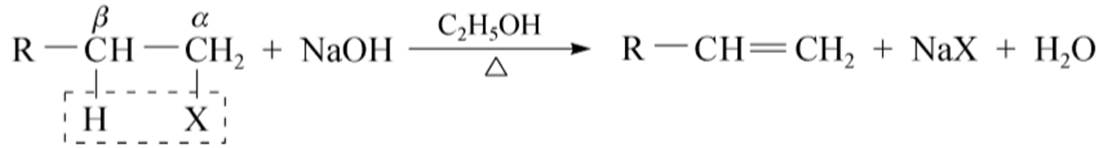
消除反应(用E表示)
反应先生成HX,后与NaOH反应。
活性:
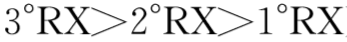
(1)优先生成稳定的共轭体系的产物
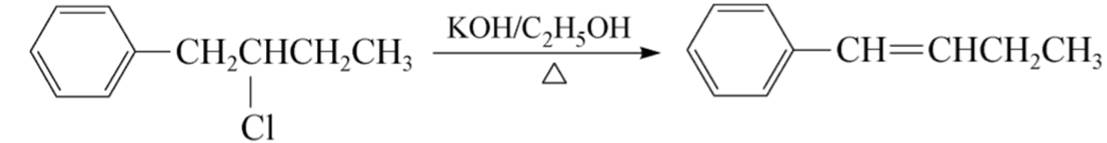
(2)札依采夫规则:与伯卤代烃不同,仲卤代烃和叔卤代烃中可能有多种不同的β-氢原子供消除,但主要消除含氢较少的β-碳原子上的氢原子,或生成双键碳原子上连有较多取代基的烯烃。
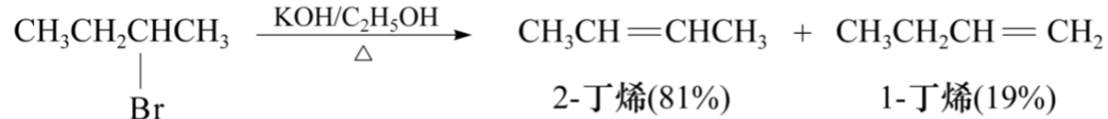
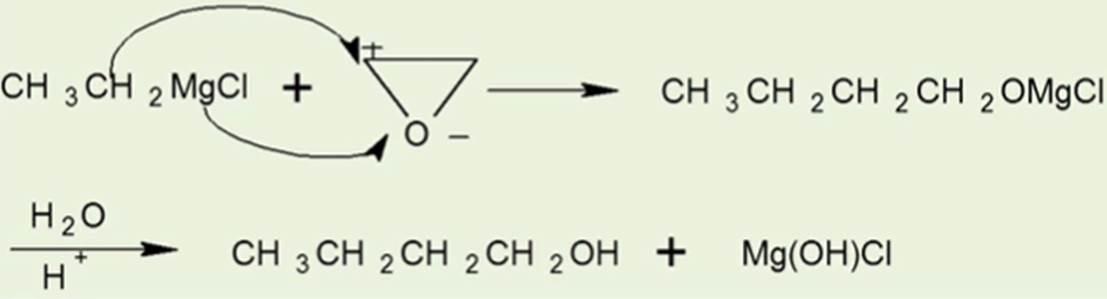
与金属反应
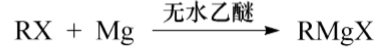
卤代烃和镁反应的活性:R-I>R-Br>R-CI
由于格氏试剂中的C—Mg键是一个极性很强的共价键,其碳原子带部分负电荷,金属镁带部分正电荷,因此其性质极为活泼。
(1)能与许多含有活泼氢的化合物(如水、醇、酸、胺)
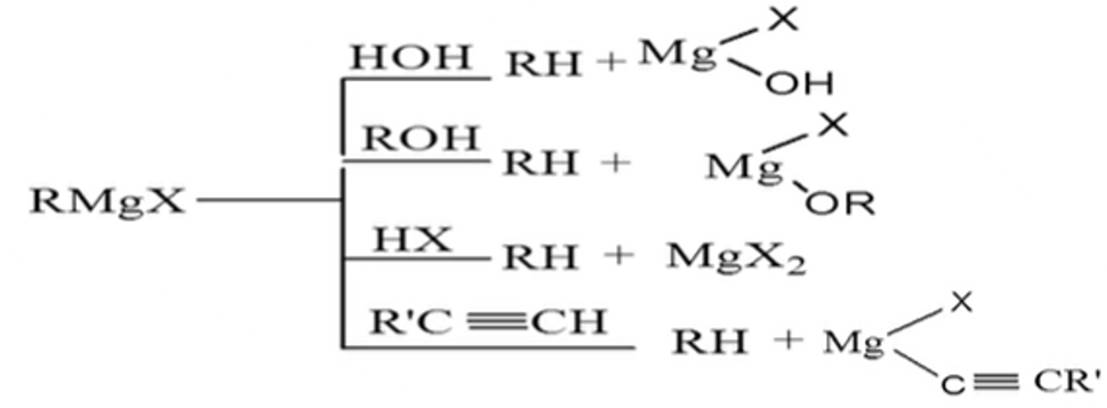
(2)能与含极性双键的化合物(如醛、酮、酯、二氧化碳等)和环氧化合物等反应
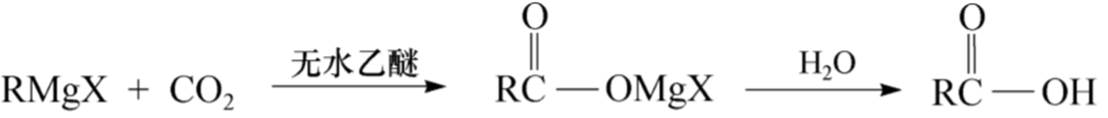
所以在制备和使用格氏试剂时都必须用无水溶剂和绝对干燥的容器,操作要采取隔绝空气和二氧化碳的措施,最好在氮气保护下进行。
苯基卤化镁和乙烯基卤化镁的制备需要在四氢呋喃中进行。

拓展:
(3)与非金属作用:

例题:
四
两种反应机理
亲核取代反应机理
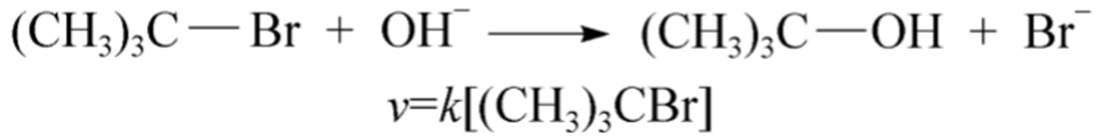
单分子亲核取代反应(SN1):
①键的断裂和键的形成先后进行
②反应速度只与一个反应物(卤代烃)浓度有关,而与碱的浓度无关
③与生成的碳正离子中间体有关
④中间体越稳定,反应速率越快
在SN1反应时,生成的碳正离子为sp2杂化,具有平面构型,亲核试剂可以从平面的两侧与其结合,生成的取代产物为一对等量对映体的混合物,即外消旋体。这种化学反应过程称为外消旋化。
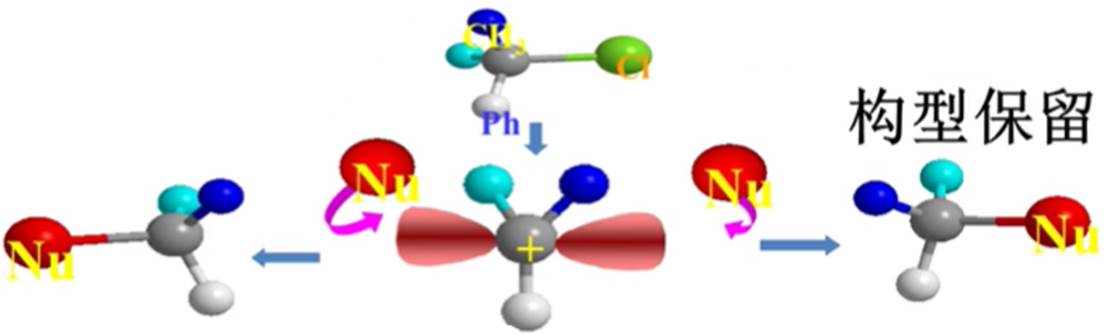
双分子亲核取代反应(SN2):
①键的断裂和键的形成同时进行
②该反应速度与两个反应物的浓度有关
③SN2反应活性主要与亲核试剂进攻中心碳原子时所受到的空间位阻有关
④中心碳原子上连接的烷基越多,空间位阻越大,活性越小
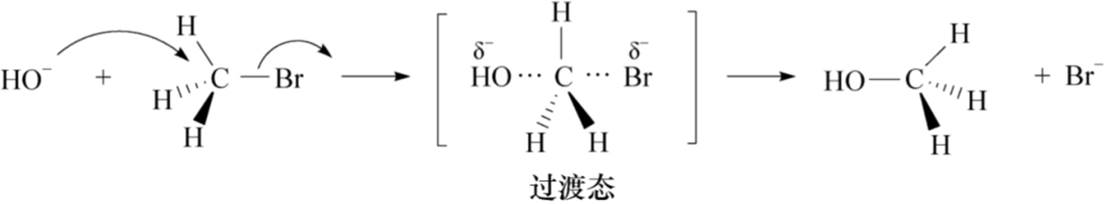
在双分子亲核取代反应中,亲核试剂只有从离去基团的背面进攻中心碳原子,其相互排斥作用才最小。中心碳原子的构型在反应过程中发生100%的反转。这种构型的转化称为瓦尔登( Walden)转化。
卤代烷的亲核取代反应既可按SN1也可按SN2机理进行,两种机理是同时存在和相互竞争的,但究竟按何种机理进行,则受卤代烷的结构、亲核试剂的浓度、溶剂的极性及离去基团等诸多因素的影响。
卤代灶的结构对反应按何种机理进行有很大影响,综合电子效应和空间位阻的结果,叔卤代烷主要按SN1机理进行,伯卤代烷主要按SN2机理进行,而仲卤代烷既可以按SN1也可以按SN2机理进行。
消除反应(E)机理
单分子消除反应(E1):
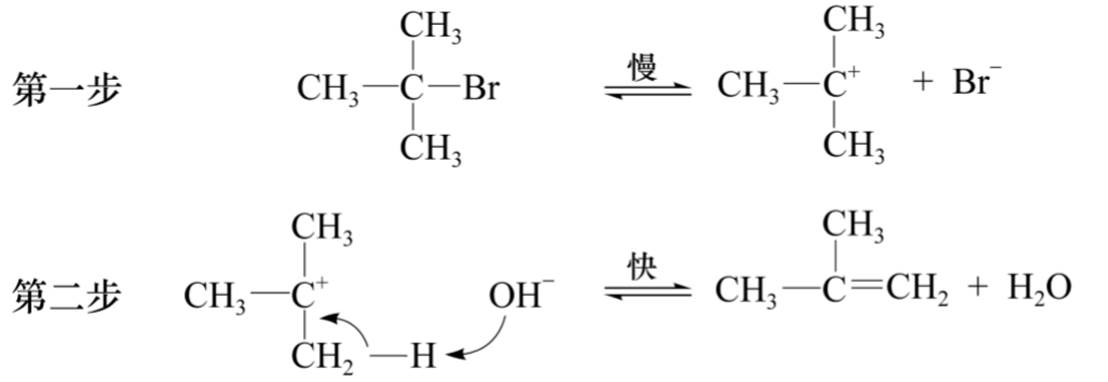
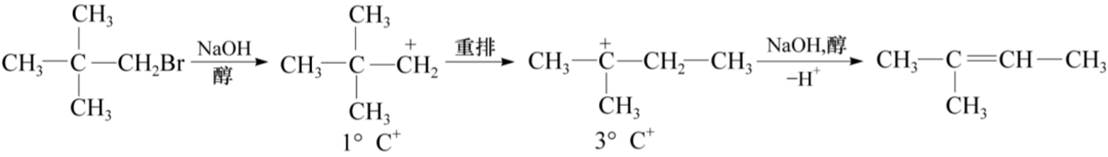
E1反应也常发生重排反应:
双分子消除反应(E2):反式共平面消除
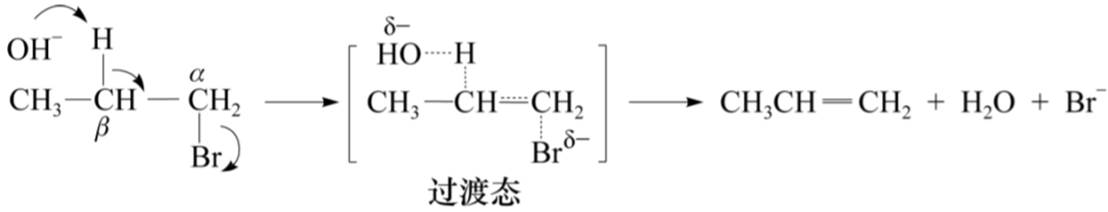
E1消除非常少见,只有叔卤代烃在没有碱的情况下进行溶剂解才有可能发生,一旦有碱存在即便是弱碱,都会发生E2消除。
消除反应速率影响因素:
E1:叔卤>仲卤>伯卤
E2:叔卤>仲卤>伯卤
E1:(1)α-C上烷基增多,反应加快——形成碳正离子的活化能降低。
(2)α-C上连有给电子取代基,反应加快——形成的碳正离子稳定。
E2:(1)双键上取代基多的烯基稳定。
(2)在E2过渡态中,α-C和β-C之间已具有部分双键的特性,因此取代基越多过渡态越易形成。
亲核取代反应和消除反应之间的竞争关系
(1)卤代烃的结构
对不同卤代烷而言,其取代和消除的倾向如下:

(2)试剂的碱性和亲核型性
强亲核试剂:I-,Br-,OH-发生SN反应
强碱试剂:NaNH2,(CH3)3CO-,R-发生E反应
试剂体积过大,因空间障碍不易进攻中心碳,但与β-H接近不受影响,有利于消除反应
(3)溶剂的极性
极性高的溶剂有利于取代反应SN,极性小的溶剂有利于消除反应E
(4)反应温度
升高温度对取代和消除都有利,但消除反应中C-H键断裂的活化能较高,因此升高温度更有利于消除反应。
五
不饱和卤代烃结构与化学活性的关系
(1)乙烯型和芳基型卤代烃。会形成p-π共轭体系,很稳定。
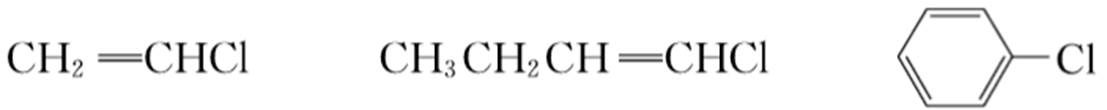
(2)烯丙基型和苄基型卤代烃。
对于SN1:容易形成稳定的中间体,最活泼。
对于SN2:双键是平面结构,空间位阻较小,也最活泼。
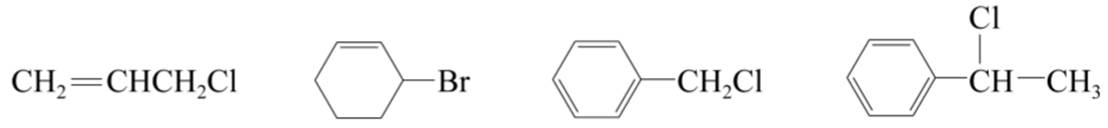
(3)隔离型不饱和卤代烃和卤代芳烃。卤原子的活泼型与烷烃相似。

综上:在进行取代反应时的活性顺序是:


图文来源于学习通教材
