有机化学知识点(六)
第七章
醇
一
分类和命名
分类
1、按烃基不同分类:
①饱和醇②不饱和醇③脂环醇④芳香醇
2、按羟基所连碳原子的类型分类:
①伯醇(一级醇1°)②仲醇(二级醇2°)③叔醇(三级醇3°)
3.按羟基数目:
①一元醇②二元醇③多元醇
命名
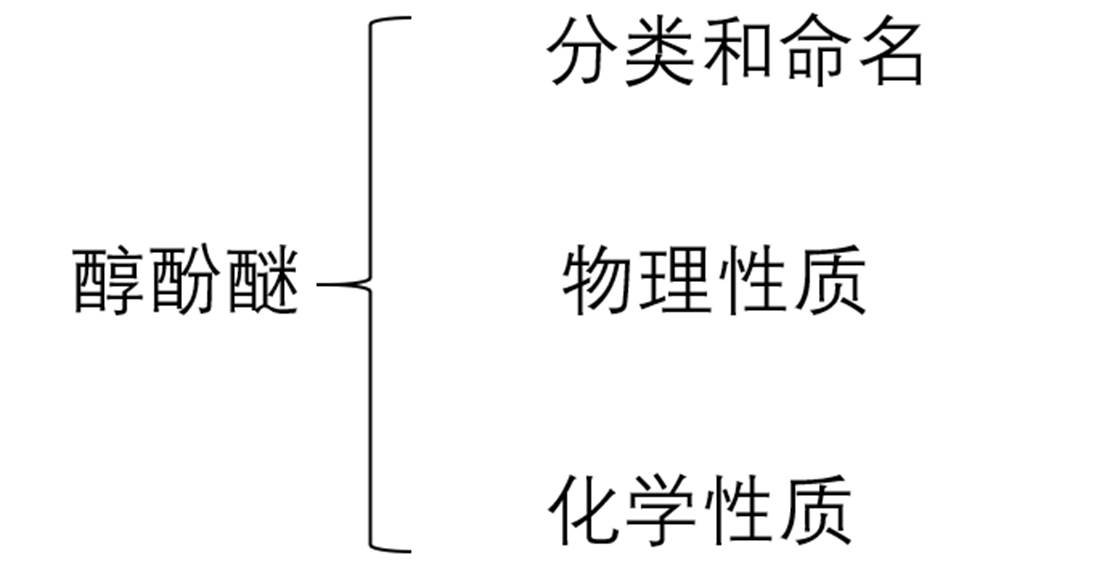
(1)普通命名法(简单一元醇):根据与羟基相连的烃基名称称作“某醇”
(2)系统命名法:
①饱和醇:选择含羟基的最长链为母体,从距离羟基最近端开始编号;根据主链上碳数称为“某醇”,并注明羟基的位次。
②不饱和醇:选择连有羟基和不饱和键的最长碳链为主链,编号从距离羟基最近端开始。
③芳香醇:把芳基看作取代基。
④多元醇:选包含多个羟基在内的最长碳链为母体,用“1,2,3……”表示其位次,用“一、二、三、四……”表示羟基的个数。
(3)俗名

二
物理性质
(1)沸点:
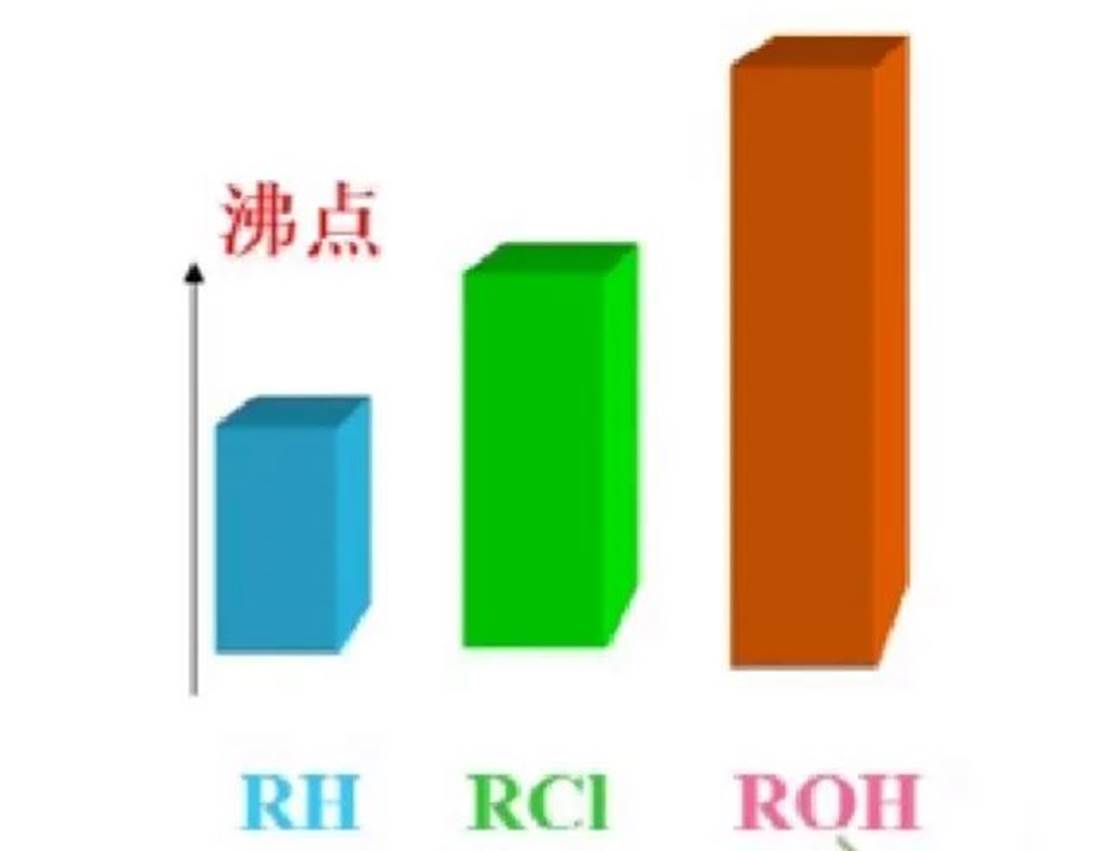
分子间作用力依次为:色散力、偶极偶极相互作用力、氢键
①低级一元醇的沸点比相应原子数烷烃的高得多。
②同碳数醇,烃基支链越多,沸点越低。
③羟基越多,沸点越高。
(2)水溶性
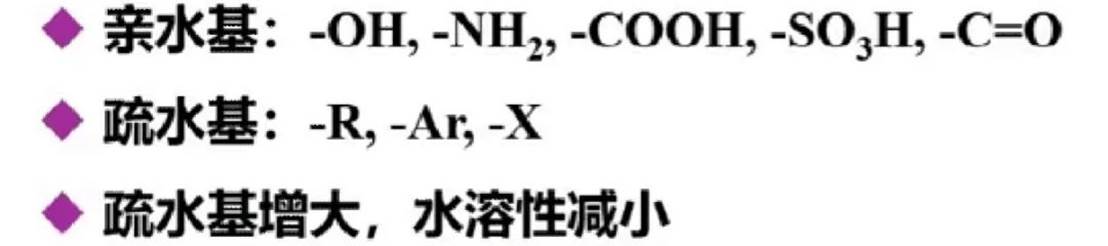
一元醇:低级醇(甲醇、乙醇)能与水互溶,随着碳链的增大,在水中溶解度显著降低。
多元醇一般可与水混溶。
三
化学性质
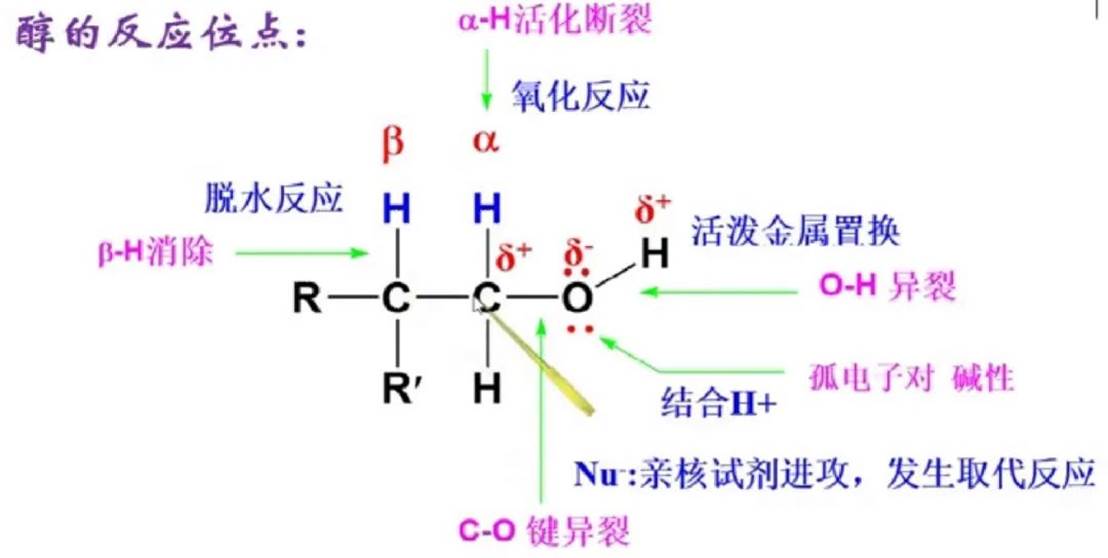
与活泼金属反应
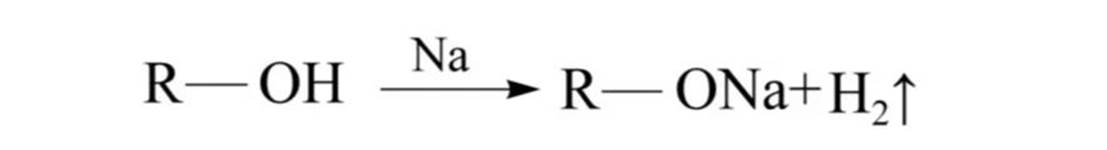
醇具有一定的酸性,能与Na、K、Mg、Al等反应
烃基具有推电子效应,使得氧原子周围电子云密度增加,O—H键极性变弱,酸性减小。
随着醇分子中α碳原子上烃基的增多,其酸性也降低。
碱性:叔醇钠>仲醇钠>伯醇钠>甲醇钠>NaOH
醇钠的水解:
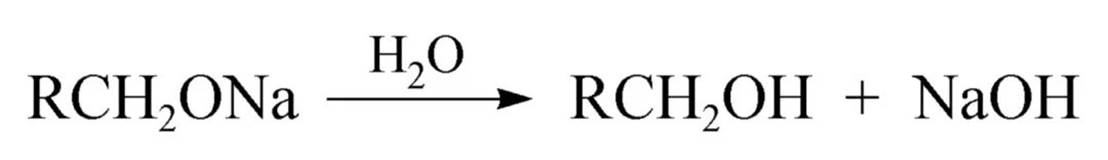
RO-的碱性比OH-强,所以醇钠极易水解。

羟基被卤素原子取代
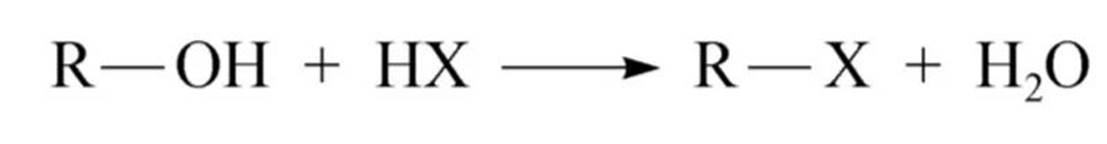
氢卤酸的反应活性顺序:HI>HBr>HCI;
醇的反应活性顺序:烯丙基型(或苄基型)醇叔醇>仲醇>伯醇。
实验室中用浓盐酸和无水氯化锌配制成卢卡斯试剂,低级一元醇能溶于卢卡斯试剂,而相应的卤代烃不溶。从反应出现浑独的时间来鉴别不同级别的醇。

醇与氢卤酸的反应是酸催化下的亲核取代反应。
通常认为烯丙醇(或苄醇)、叔醇、仲醇按SN1机理进行,而伯醇较难形成碳正离子,一般按SN2机理进行。
注意:醇可以与PI3(或PBr3),PCI5或SOCI2,反应生成相应的卤烷,而不发生重排。
脱水反应
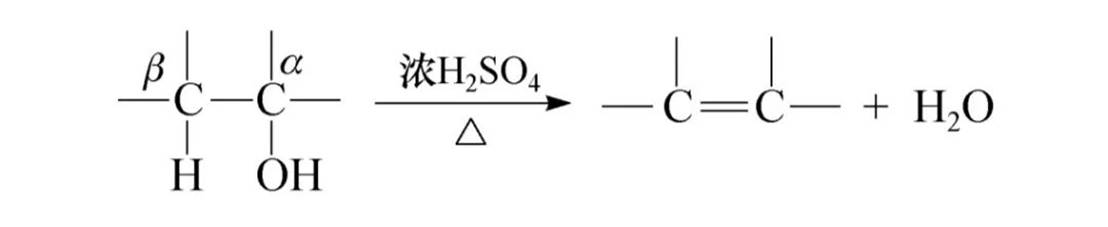
脱水活性顺序为叔醇>仲醇>伯醇。
醇在强酸作用下的分子内脱水是按El机理进行的,脱水反应的活性取决于碳正离子中间体生成的难易。
由于El机理经过碳正离子中间体,因此有些醇脱水时可能发生重排。
分子间脱水:
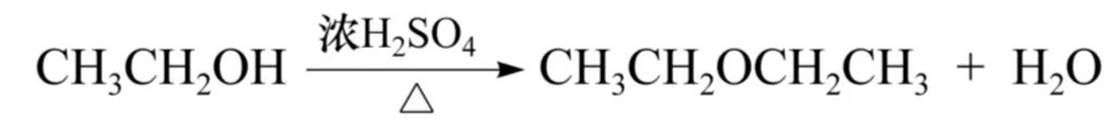
成酯反应
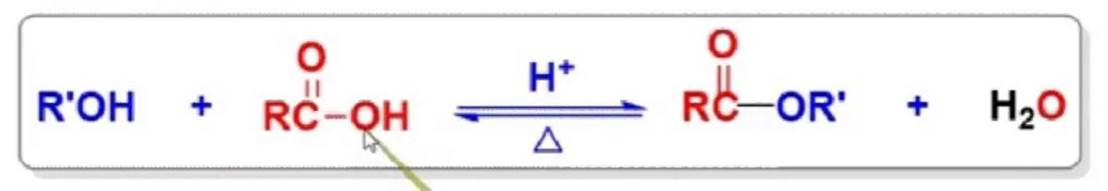
醇也可以与含氧的无机酸反应生成无机酸酯。
氧化反应
酸性高酸钾或重铬酸钾是常用氧化剂,可以将醇氧化。伯醇首先氧化成醛,醛不稳定,再继续被氧化成酸,仲醇被氧化成酮。(紫色褪去,橙色变为绿色)
沙瑞特试剂(CrO3和吡啶的配合物)可以将伯醇或仲醇氧化成相应的醛或酮,同时双键不受影响。
伯醇、仲醇脱氢生成醛和酮:
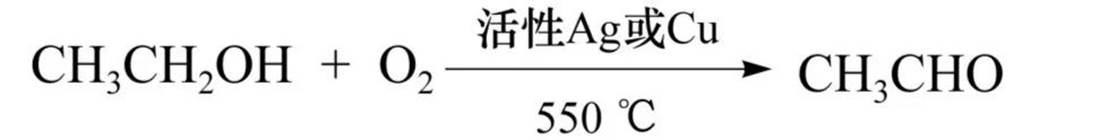
酚
一
分类和命名
分类
①一元酚②二元酚③多元酚
命名
①一般命名,以酚为母体,有时也将羟基作为取代基。
②遵循芳香烃衍生物的命名原则。【可参照有机化学知识点(三)】
二
物理性质
(1)沸点:
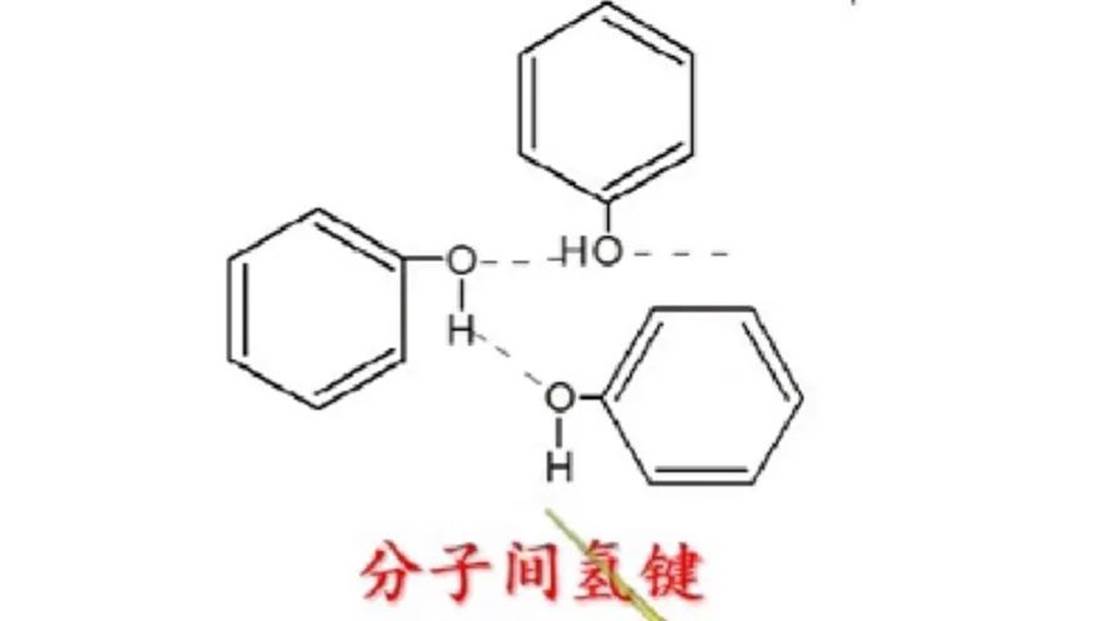
熔点和沸点比分子量相近的芳烃或芳基卤代物高。
当酚羟基的邻位有硝基、羟基等基团时,由于可以形成分子内氢键,不易形成分子间氢键,因此其沸点都比相应的间位、对位取代产物的沸点低。
(2)水溶性
苯基疏水且苯酚体积很大,苯酚微溶于水(9g),溶于苯、乙醚、乙醇等。
三
化学性质
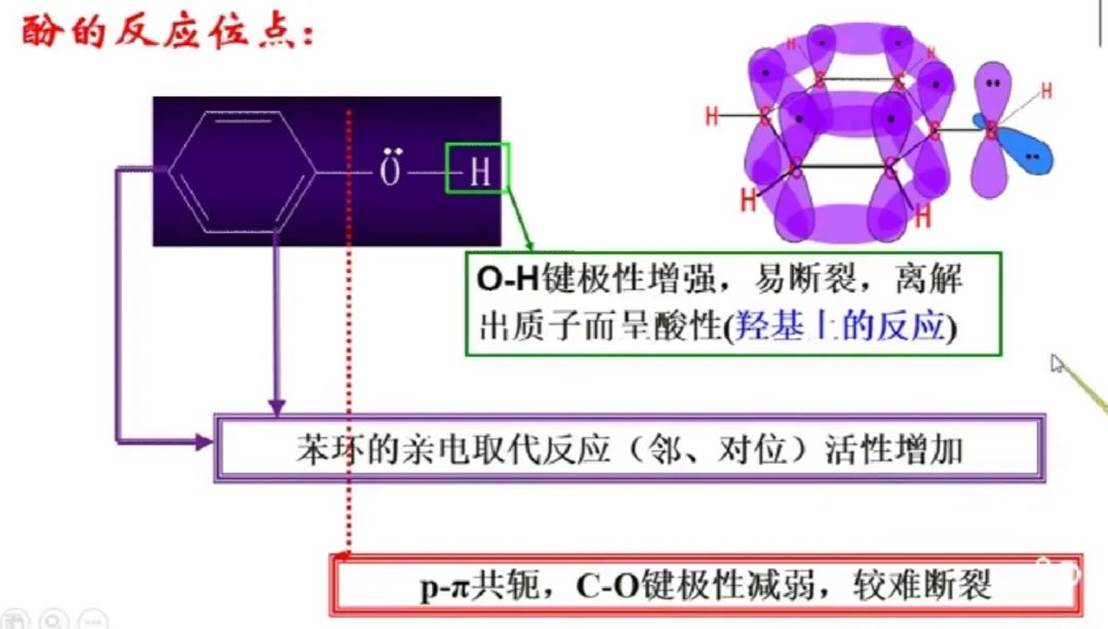
酸性
共轭体系中,氧原子上的电子云向苯环上转移,从而使得苯环上电子云密度增大,而氧原子上电子云密度减小,氢氧键更易断开,呈现酸性。
苯环上连有吸电子基团(如一NO2、—F等)时其酸性增强,且吸电子基团越多影响越大。
当苯环上连有供电子取代基(如一CH3、—NH2等)时,它们会使苯环上的电子云密度增大,从而使得酚羟基不易解离释放出质子,所以酸性比苯酚的酸性弱。
与FeCl3显色反应
酚和具有烯醇式结构的化合物能与FeCl3显色,生成蓝紫色物质。
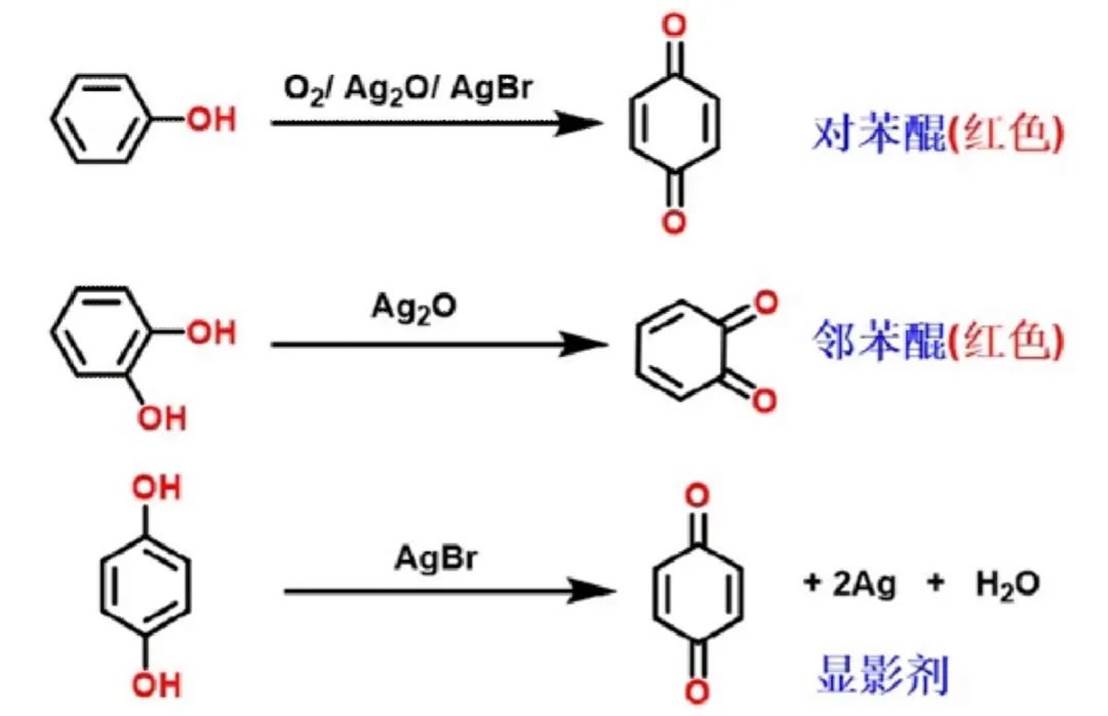
氧化反应
酚易被氧化,将苯酚长期贮存,因与空气接触而氧化。
酚醚和酚酯的形成
酚与醇不同,通常很难发生分子间的脱水反应生成醚。酚醚一般是在碱性条件下生成酚盐后再与卤代烃或硫酸酯作用得到。
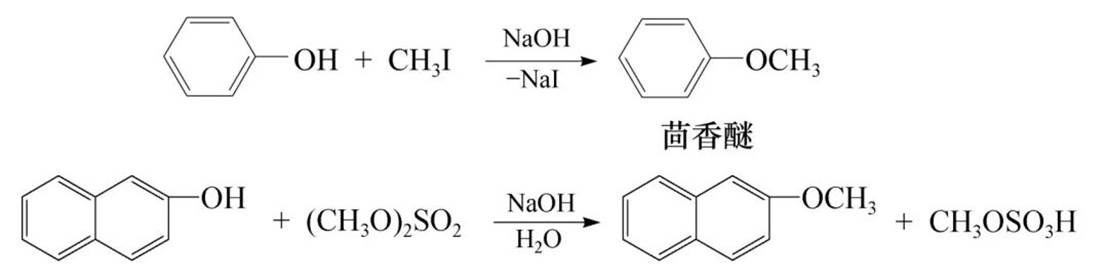
芳环上的取代反应
邻对位取代【可参照和有机化学知识点(三)】
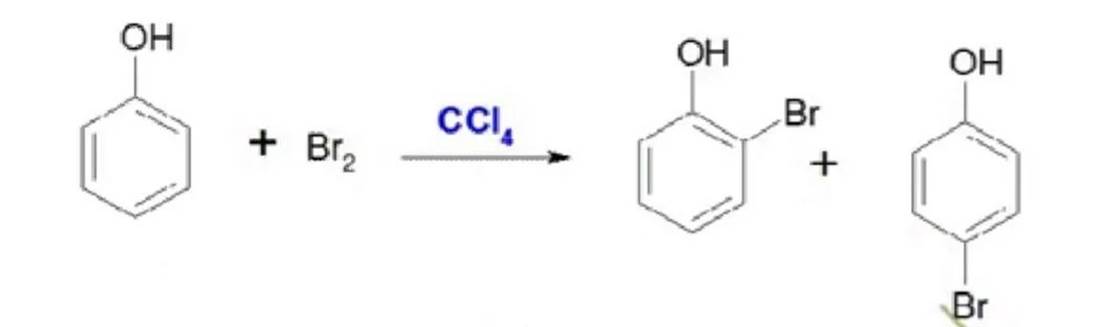
(1)卤代反应
在非极性溶液中,控制溴的用量。
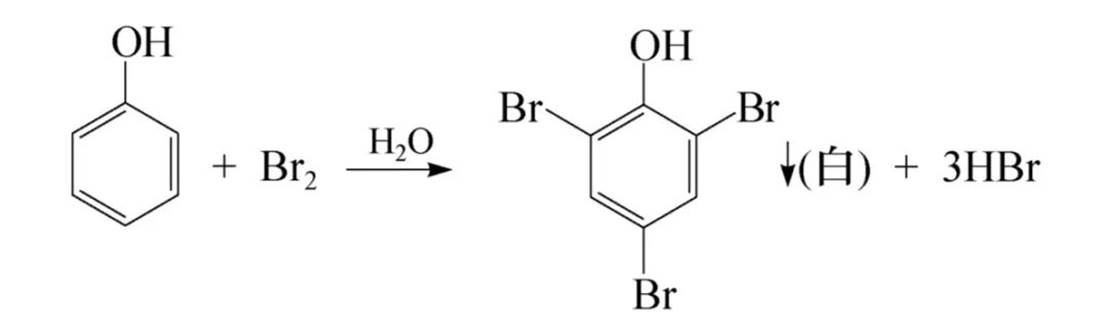
苯酚与溴水常温下立即反应生成白色沉淀,反应灵敏,很稀的苯酚溶液(小于等于10^-6g·L-1)就能与溴水生成沉淀,可用作苯酚的鉴别和定量测定。
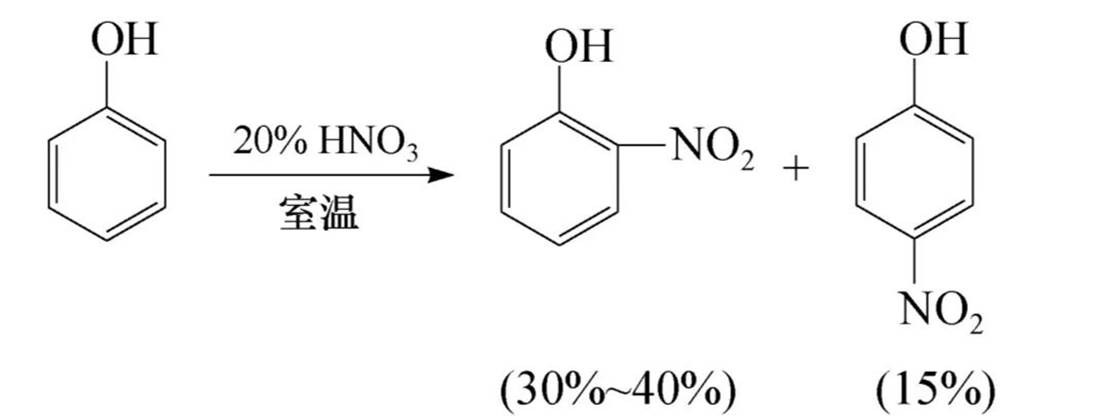
(2)硝化反应
用浓硝酸很容易引起的氧化。产物中,前者由于形成分子内氢键使得其沸点和溶解度较低,可以随水蒸气蒸出,而后者形成分子间氢键,不易被蒸出。
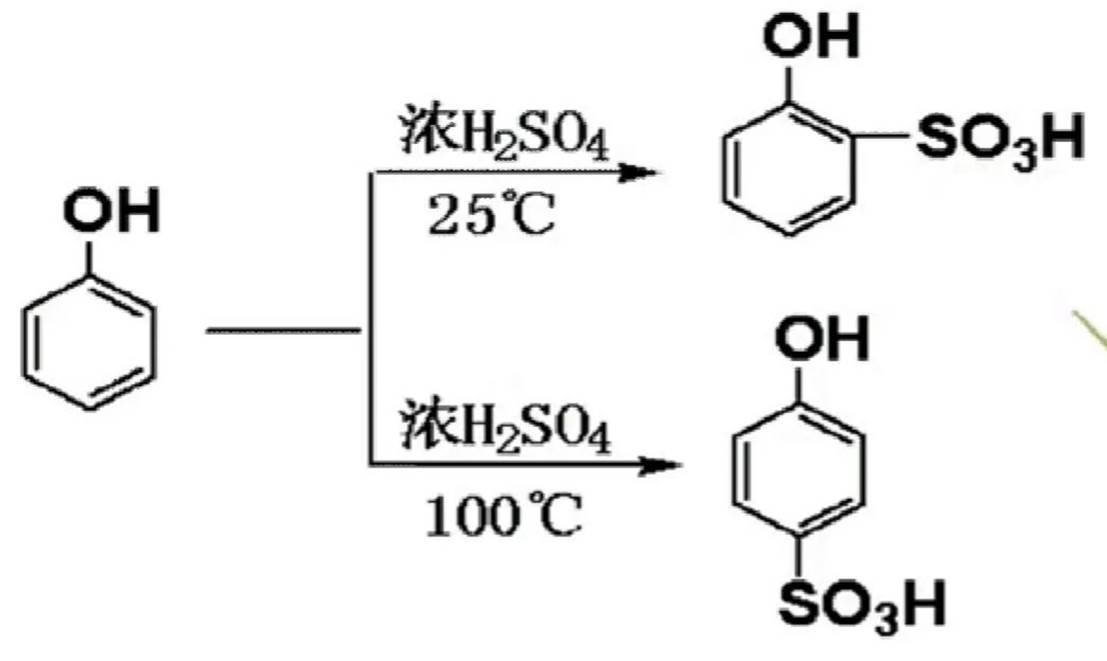
(2)磺化反应
低温有利于动力学反应产物,高温有利于热力学反应产物。
醚
一
分类和命名
分类
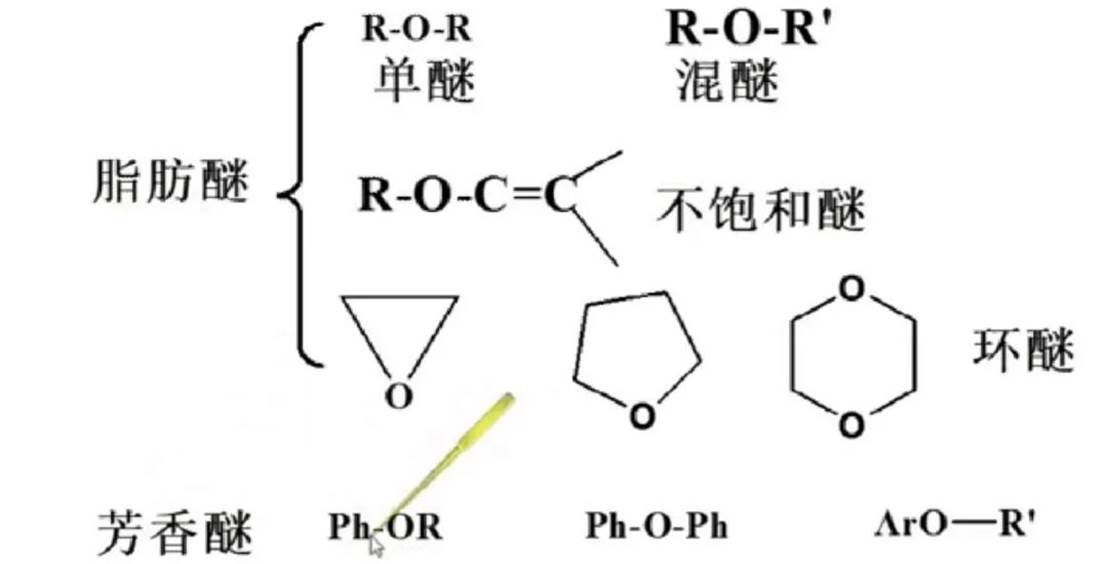
命名
(1)脂肪族单醚:在醚前面加上烃基的名称,省略“二”字。
(2)芳香族单醚:在醚前面加上芳基的名称,“二”字不能省略。
(3)混醚:小基团在前,大基团在后,如含芳基则芳基在前。
(4)结构复杂的醚:把RO-(或ArO-)当作取代基。
(5)环醚:以“环氧”为词头,标明环氧在碳链的位次。
(6)多元醚
二
物理性质
①弱极性,小分子的醚可以与水或醇形成氢键,在水中的溶解度比烷烃大,并能溶于许多极性溶剂中。
②无分子间氢键,沸点与烃相近,液态有挥发性,易燃易爆。
三
化学性质
碱性(钅羊盐的形成)
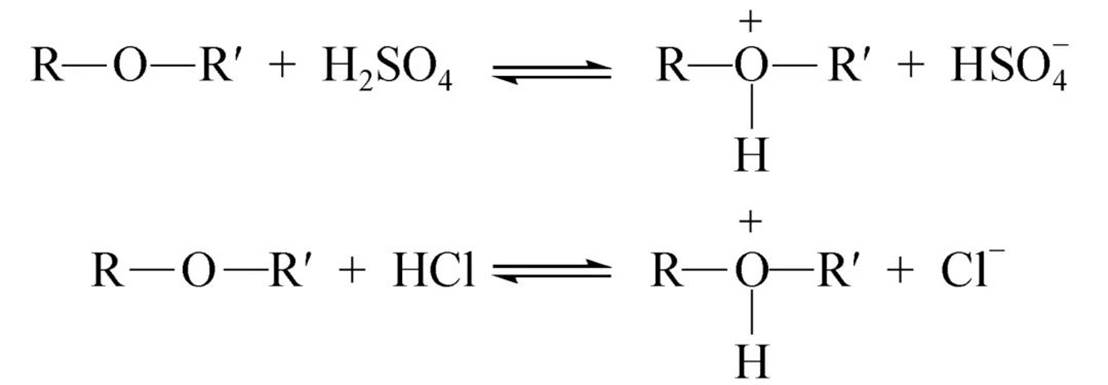
醚溶于强酸,可鉴别或分离醚与烷烃(或卤代烃)
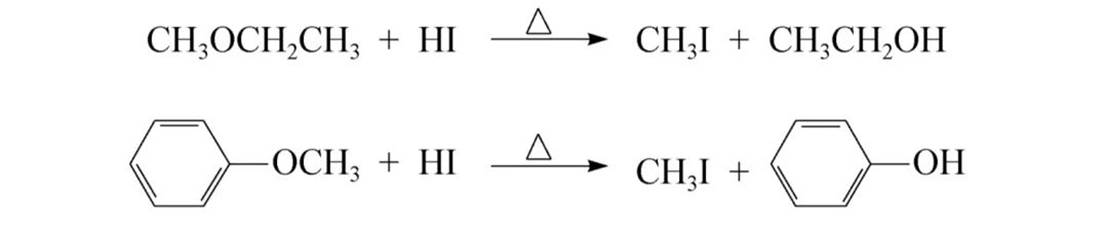
醚键的断裂
生成的醇会和过量的卤化氢反应:
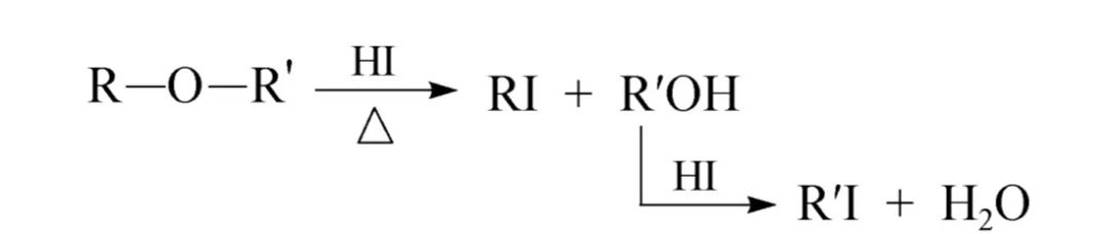
混合醚反应时,一般是小的烃基断裂生成卤代烃,大的基团或芳基生成醇或酚。酚不和过量的卤代烃反应。
过氧化物的形成
醚的α-位碳原子上连有氢原子时,能被空气中的氧气氧化生成过氧化物。
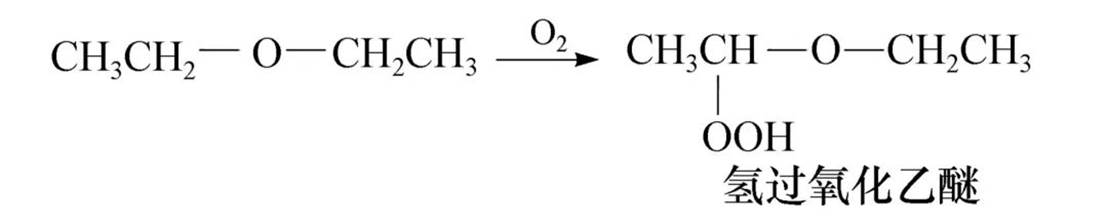
形成的过氧化物容易爆炸,所以储存时间长的醚在使用前必须进行检验过氧化物是否存在。
检验方法:KI/淀粉试纸;
现象:蓝色;
除去办法:用FeSO4或Na2SO3稀溶液洗涤。
四
环醚
环氧乙醚
制备:
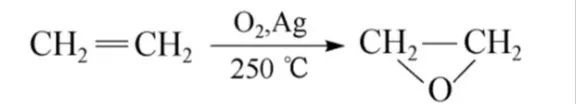
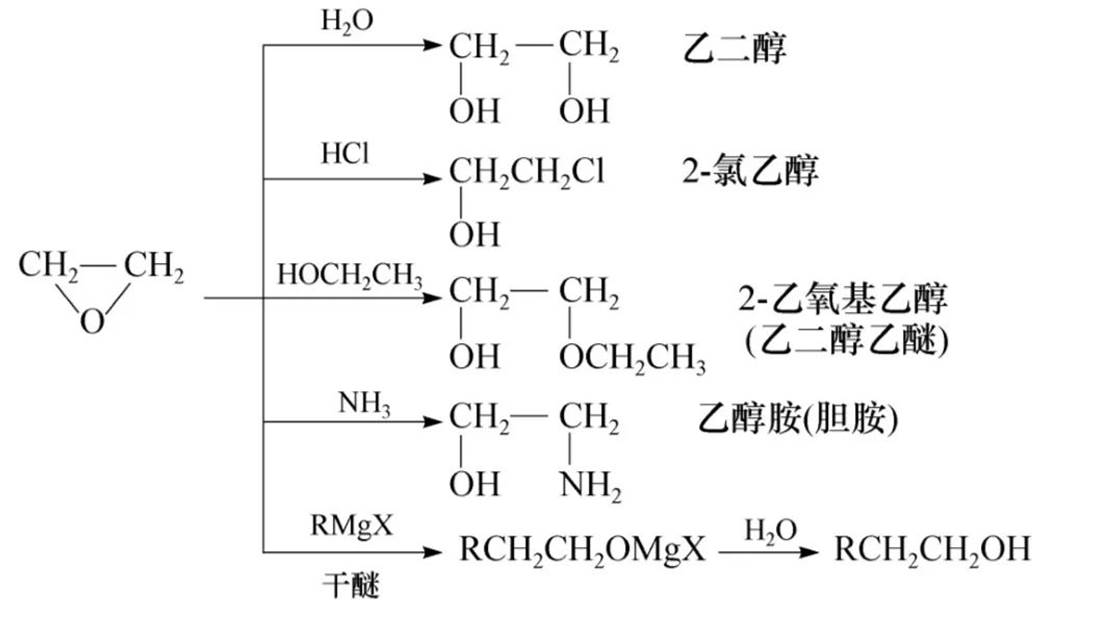
小环的环烷烃由于键角很小,容易发生开环反应,亲核取代反应,一般是SN2反应。
最后一个反应是增加两个碳原子的方法。
冠醚
命名:
X-冠-Y X:成环原子总数 Y:环中氧原子指数
络合作用:分离金属离子
可做催化剂,使无机物与有机物反应


图文来源于学习通教材
